原位捕获异氰乙酸酯环加成形成的环亚胺中间体的研究:组装
顺式-3a,8a-六氢吡咯并[2,3-b]吲哚骨架
原文作者: Lin Huang, Hengguang Cheng, Runmei Zhang, Min Wang, and Chunsong Xie,
单 位: 杭州师范大学
摘要:在铜或银与碱的共催化作用下,由异氰乙酸酯与烯烃通过环加成作用生成的2H-吡咯啉中间体可以被原位引入进一步的反应。基于这一策略,发展了一种收敛、温和、原子经济的组装系列生物活性天然产物核心的顺式-3a,8a-六氢吡咯并[2,3-b]吲哚骨架的新策略。
关键词:环加成;多米诺反应;六氢吡咯并[2,3-b]吲哚;异氰基乙酸酯
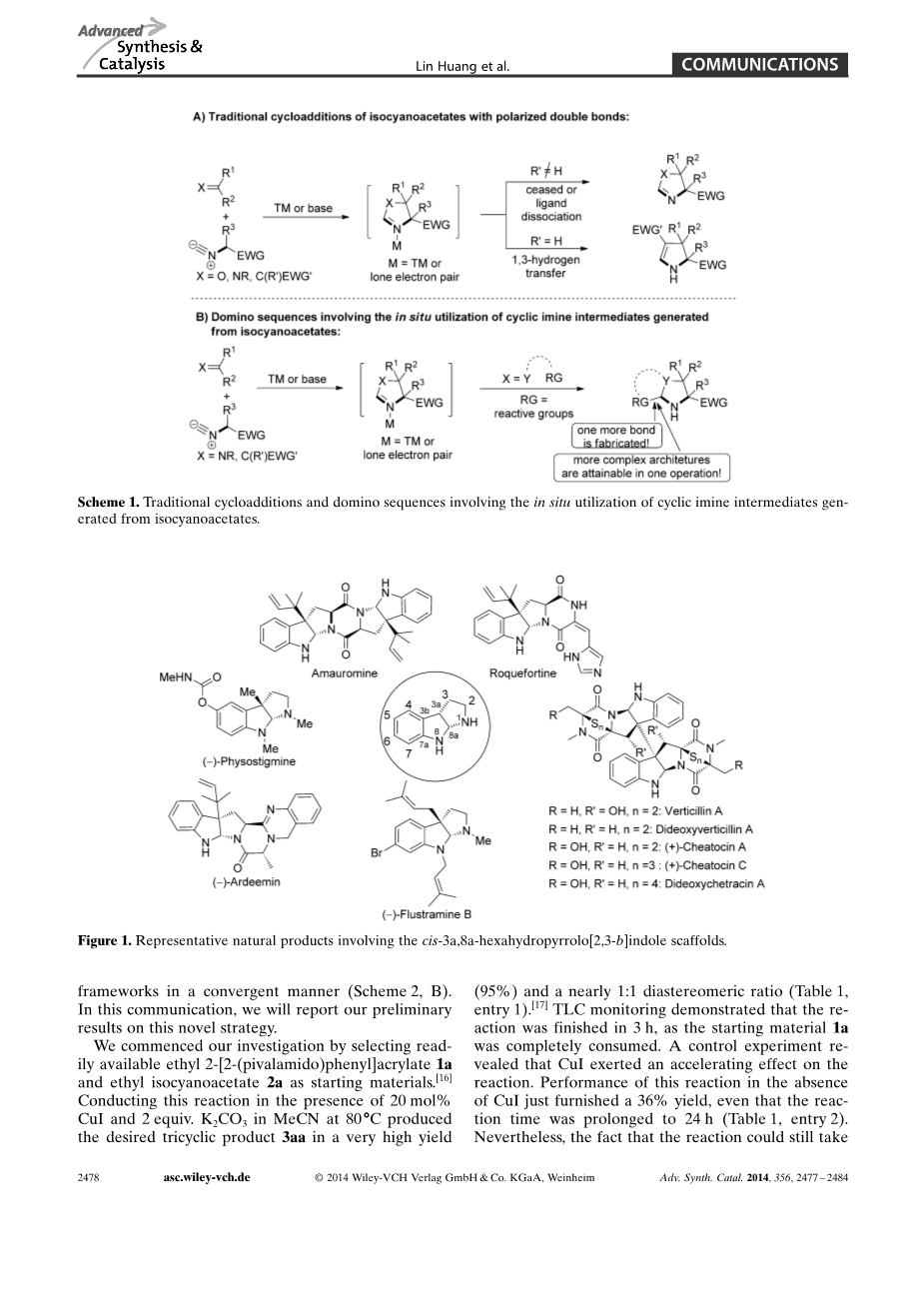
在过去几年中,利用异氰基乙酸酯合成杂环化合物备受关注。从反应机理看,这些反应过程通过异氰基乙酸酯与极化双键的[3 2]环加成作用生成环状亚胺中间体。(图1)但是,中间体形成后,反应总是停止,或生成氢转移产物(图1,A )。原位利用这些环状亚胺中间体的进一步转化,构建更多复杂的结构,至今仍然较少报道。但这一理念是否可以扩大到更多的反应底物,并形成更广泛的结构,值得进一步研究。
顺式-3a,8a-六氢吡咯并[2,3-b]吲哚(HPIS)是嵌入在大量生物活性天然产物的核心支架,典型示例包括胆碱酯酶抑制剂毒扁豆碱,强效血管扩张剂,多药耐药逆转剂和潜在的赖氨酸特异性的组蛋白甲基转移酶(HMT)抑制剂-毛壳素等。
这些显著的生物活性,促使其构建方法被广泛研究。从逆合成角度看,这些环化合物往往在C-8A-N-1键处断开,侧链氨基的亲核进攻形成的吲哚啉中间体(或他们的等同物,如环丙烷)闭环,得到所需的三环框架。然而,作为一种偕二胺结构,毫无疑问的是顺3a,8a-六氢吡咯并[2,3-b]吲哚的合成是通过C-8A-N-8逆合成的(图2,B)。原则上,如果2H-吡咯啉中间体可利用,那么这一步骤是可行的。假设通过芳基团分子内的亲核环状结构与亲电的2H-吡咯啉中间体合成顺-3a,8a-六氢吡咯并[2,3-b]吲哚是容易的。考虑到2H-吡咯啉中间体可通过异氰乙酸酯和缺电子烯烃的[3 2]环加成合成。我们设想以邻氨基苯乙烯作为反应底物,通过串联反应和原位取代得到亚胺中间体,以收敛方式聚合形成顺-3a,8a-六氢吡咯并[2,3-b]吲哚框架(图2 ,B)。在这个交流会上,我们将初步报告我们的新发现。
我们选择容易获得的2-[2-(新戊烷氨基)苯基]丙烯酸乙酯1a和异氰基乙酸乙酯2a作为原始材料。该反应在20 mol%的2当量碘化亚铜,碳酸钾,80℃乙腈条件下进行,得到产率高达95%,对映选择性为1:1的三环产品3aa。TLC监测显示反应了3个小时,原料1a被反应完全。检测控制显示CuI加速了反应的进行。显示表明,在没有碘化亚铜时,反应时间延长至24h也仅有36%的产率。事实上,该反应在没有过渡金属催化剂时仍可进行,例如可用弱碱碳酸钾来促进反应进行。进一步控制实验显示,碱在该反应中至关重要。在没有碱时,该反应不能发生,起始原料没有发生变化(表1,条目3)。其他铜催化剂,例如CuCl, CuBr and Cu (OAc)2,也能够催化该反应,但得到的产率略低于CuI。银盐,例如AgOAc 和 Ag2CO3 ,也是很好的催化剂,催化效果与CuI相当,这使得我们的催化剂有了更多的选择。
把碱改为Cs2CO3显示反应效率并没有改变,在相同时间内仍有高产率(91%),但是,当用有机碱,例如用Et3N和DBU取代碳酸钾时,反应变差,效率变低(23%和24%)(表1,第10和11)。其他溶剂,如DCE和THF,在反应中也显示了较好的选择性(表1,第12和13)。高效率(92%和90%)的获得表明该串联反应有广泛的溶剂选择。降低反应温度似乎是不利的,当在60℃和室温下进行反应时,延长反应时间(12h和36h)也只有中等的产率(51%和43%)(表1,第14和15)。值得注意的是,该反应在有大量的碳酸钾时可稳定的进行。在进行该反应时,用20mol%的碳酸钾作为碱,3h产率可达到92%(表1,第16)。该反应具有最显著的经济效益,因为所有的CuI和K2CO3都运用到催化过程中。而且,值得强调的是,该反应的非对映选择性在各种条件下保持恒定。虽然,在该条件下,C-2的内切结构稍微变化,但内旋与外旋仍保持接近1:1的最优比。
随着操作条件的优化,我们接下来研究该反应的适用范围,并把结果概括于表2中。2-[2-(新戊烷氨基)苯基]丙烯酸酯,苯环上的取代基(包括供电子基和吸电子基),例如1b和1c在反应中也起作用,得到我们所需的高产率(87%和82%)的三环产品3ba和3ca和1:1的非对映选择性(表2,第2和3)。氯原子在该反应中可促进衍生物的生成。此外,乙基-2-[2-(新戊烷氨基)苯基]丙烯酸酯在beta;位上的芳烃或烷基基团,无论是顺式或反式,都能与异氰乙酸酯2a很好的反应,形成所需的具有手性中心的4个产品,而且有较好产率(56%-82%,表2,第4-7)。根据顺式/反式取代基的特性,反应的非对映选择性也不同,顺式取代基比反式能获得更高的非对映选择性,但所有的反应都形成endo酯。
此外,被取代的异氰基乙酸酯,例如alpha;-烷基苄基异氰基乙酸乙酯2b和alpha;-芳基异氰基乙酸乙酯2c作为主要反应物。能获得高的反应产率(93%和84%)和确定的非对映选择性(表2,第9和10)。当alpha;-芳基异氰基乙酸乙酯2c作为反应物,主要获得的是endo型的吡咯啉。以alpha;-烷基苄基异氰基乙酸乙酯2b为反应物主要获得的是exo型的吡咯啉。实际上,乙基异氰乙酸酯、苄基异氰乙酸酯在反应中都被反应,表明了在烷基酯类中有较广的选择性。此外,这些结果连同之前的第4-7的结果表明,串联反应阶段取代在C-2或C-3位置更容易。由于以色氨酸为基础,获得环状的非天然氨基酸总是需要多个步骤,所以这一结论很重要。
除了这些,异氰酰胺诸如2d也可以与2-[2-(新戊烷氨基)苯基]丙烯酸酯1a很好的反应,得到高产率(96%)和中等的非对映选择性(图2,第10)。因为在C-2位置上连接有酰胺功能基团的顺式-3a,8a-六氢吡咯并[2,3-b]吲哚是很多天然产物的基本支架,所以这一结果特别重要。有趣的是,丙烯酸酯基alpha;位上有一个芳杂环,例如乙基2-[2-(新戊烷氨基)苯基]丙烯酸,也可以进行该反应,得到六氢吡咯并[2,3-b]氮砸吲哚,经过3h,反应率为55%,非对映体比率为1:1(表2,第11)。这一结果是很有意义的,因为7-氮吲哚的有效性已被开发运用。而通过HPIS获得六氢吡咯并[2,3-b]氮杂吲哚结构目前尚不能实现(图2,A)。
由于Cu(I)催化环状物时表现较差的非对映选择性,我们做了一系列的实验来改进它(表3)。首先,考虑到两个苄基之间的Pi;-Pi;键作用力,有利于形成C-2-异构体,我们把烷基酯换成苄基。但是,在标准条件下,我们发现这是无用的。这两种异构体的比列仍为1:1,总收率减少到42%(表3,条目1)。把催化剂Cu(I)改为Ag2O,该反应能在室温下进行,得到更好的产率(60%)和更好的非对映选择性(2:1,)(表3,条目2)。
假设1和2的酯基团空间位阻增大,有利于非对映选择性的增加。我们把1或2的烷基酯改为叔丁酯,得到endo酯。虽然反应产率非常好(85%和71%),但反应的非对映选择性仍保持中等水平(3:1到2.5:1)。当我们用叔丁基2-[2-(新戊烷氨基)苯基]丙烯酸酯和叔丁基异氰基作为取代基时,得到类似的结果(85%的反应率,2.8:1的非对映选择性比)(图3,条目5)。这些结果表明1和2的酯基团对非对映选择性的影响不大。
降低反应温度似乎对反应的非对映选择性有一定的影响。当反应温度为0℃时,非对映选择性可提高到4:1,但即使反应时间延长至12h,反应效率也仅有29%,所以降低反应温度是不可行的。当反应温度为-20℃时,反应20h,也仅仅有1:2的非对映选择性和25%的反应效率。然而有趣的是,我们观察到exo型比endo型有更好的选择性。
最后,我们改变1的氨基保护基团去观察保护基团的性质是否对非对映选择性有影响。当把1的氨基保护基团由三甲基乙酰改为甲基磺基,反应产率几乎达到100%,但非对映选择性仍保持在同一水平(表3,第8)。接下来,我们把1的保护基团改为乙酰基,猜想减少空间位阻会有利于非对映选择性。但是,再次发现是没用的。两个可分离异构体的比率仍为2:1左右(图3,第9)。尽管如此,这些结果及上诉结论仍是很有意义的。因为证明了2-(2-酰胺基)丙烯酸酯1在酯基团和氮基团上具有更多的选择性。异氰乙酸酯2在酯基团上也有更多的选择性。即使在室温下,他们也能很好的反应,得到很好的收率。
从反应机理考虑,关于过渡金属催化的异氰乙酸酯与缺电子烯烃的[3 2]环加成已有很多研究。反应先形成亲核的过渡金属异氰基乙酸酯中间体(图3)。接着,烯醇和异腈经过迈克尔加成和亲核加成反应得到[3 2]加合物。在反应中,我们推测有类似的步骤。生成[3 2]环加合物B后,可能有两种途径。第一(途径一)B分子内分子间质子作用力发生变化,形成2H吡咯啉中间体C和再生碱。C再进行分子内亲核加成得到最终产物六氢吡咯并[2,3-b]吲哚。然而,另一个途径(路径2)化合物B分子内 1,5-氢核转换成CU(I)或Ag(I),提供了酰胺化阴离子中间体C”,分子内酰胺化阴离子的亲核部分进攻2H-吡咯随后得到最终产物六氢吡咯并[2,3-b]吲哚3,得到的碱循环使用。
我们利用同位素标志法来区分这两种途径,实验过程如图4。使用 alpha;,alpha;-双氘代异氰基乙酸酯与1a反应,得到1.3:1的非对映选择性,含氘的产物3aa-d占总生成物的77%。核磁共振光谱分析3aa-d发现氘部分转移到了C-8A的位置,并没有迁移到N-1位置。这个结果表明环亚胺- CU(I)或Ag(I)中间体B发生途径一的反应,在[3 2]环化后可能进行分子间质子转移,不太可能发生途径二的反应。
总之,我们已经证实使用邻氨基苯乙烯作为底物时,由异氰基乙酸酯和缺电子烯烃环加成作用生成瞬态的2H吡咯啉中间体是可行的,形成了新型的顺-3a,8a-六氰吡咯并[2,3-b]吲哚,是大量的天然生物的核心支架。优化反应条件显示该反应在温和条件下进行,经过反应范围研究表明各种官能团可共存。提出了通过分子间的质子转移,酰胺基团上的亲核离子进攻环亚胺中间体的机理。在用异氰基乙酸酯环加成生成瞬态环亚胺中间体的基础上,我们进一步研究新的合成方法,以及不对称HPIS的合成,和HPIS在生物学重要天然产物上的运用,目前我们实验室都在进行研究中。
实验部分
典型过程
向干燥烧瓶中,加入2-[2-(新戊酰氨基)苯基]丙烯酸乙
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 8 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[287671],资料为PDF文档或Word文档,PDF文档可免费转换为Word
课题毕业论文、文献综述、任务书、外文翻译、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 一种基于罗丹明B衍生物的Fe2 和Hg² 的溶剂调控荧光检测方法外文翻译资料
- 基于激光诱导相变潜热释放特性的透明薄膜的微纳光刻外文翻译资料
- 防聚集:氧化石墨烯在烷基酚聚氧乙烯(7)醚和2-甲氧基乙醇混合介质中的还原外文翻译资料
- WPU/CB/GO纳米复合材料:原位聚合制备、热性能 和防腐性能评价外文翻译资料
- 酶敏感和两亲的聚乙二醇聚合物-紫杉醇前药纳米颗粒以增强稳定性和抗癌效果外文翻译资料
- 聚合物测试外文翻译资料
- 用于三模态的多功能稀土自组装纳米系统.上转换发光/荧光/ 正电子发射断层扫描成像外文翻译资料
- 微囊化技术:一种低温保存和增殖人类胚胎干细胞的有效工具外文翻译资料
- 基于金纳米粒子单层石墨烯-Ag纳米星阵杂化系统的高性 能表面增强拉曼散射传感研究外文翻译资料
- 聚偏氟乙烯与功能化氧化石墨烯纳米复合薄膜的结构和摩擦学性能外文翻译资料


