miR156靶向SPL转录因子对拟南芥花青素生物合成的负调控
摘要:黄酮类化合物通过一种能产生多种次生代谢产物的重要代谢途径合成,包括花青素、黄酮醇、黄酮和原花青素。花青素和黄酮醇来源于苯丙氨酸,并且具有共同的前体二氢黄酮醇,二氢黄酮醇是黄酮醇合成酶和二氢黄酮醇4-还原酶的底物。在拟南芥的茎中,花青素以顶向方式积累,在莲座与茎的接合处含量最高。研究表明,这种积累模式受miR156靶向的SQUAMOSA启动子结合蛋白样(SPL)基因的调控,SPL基因是一种高度保守的基因,并且在调控相变和开花过程中发挥重要作用。miR156活性的增加促进花青素的积累,而miR156活性的降低则会导致黄酮醇含量的增加。我们有进一步的证据表明,miR156的至少一个靶点,即SPL9,能够通过破坏MYB-bHLH-WD40转录激活复合物的稳定,直接阻止花青素生物合成基因的表达,从而负调控花青素的积累。我们的研究结果揭示了花青素转化与次生代谢之间的一种直接联系,并为调控植物花青素和黄酮醇含量的研究提供了一个潜在的靶点。
1. 引言
黄酮类化合物是一种广泛存在于植物界中的主要的苯丙素类代谢物,包括模式物种拟南芥。这些二苯基色胺化合物通过为植物提供红色、蓝色和紫色色素来抵御紫外线辐射,吸引传粉者和其他有益生物,或介导植物与微生物之间的相互作用,在植物生长发育中发挥重要作用(Buer等,2010)。此外,许多简单的黄酮类化合物具有抗氧化特性,因此可能被用作人类健康的膳食营养制剂(Winkel-Shirley, 2001;Liu等人,2006)。黄酮类化合物的生物合成产生了多种结构上不同的亚类,包括黄酮醇、黄酮、异黄酮、花青素和原花青素。在拟南芥中,最常见的黄酮醇是山奈酚糖苷,在受到紫外线照射后槲皮素糖苷水平升高(Veit和Pauli, 1999)。另一组类黄酮化合物是花青素,根据光照水平和营养状况,花青素在拟南芥叶片和茎中以不同的量积累(Holton和Cornish, 1995)。糖基化和酰基化的花青素衍生物构成了成熟拟南芥叶片和茎中的主要花青素(Bloor和Abrahams, 2002)。
黄酮类物质的主干部分是通过中心类黄酮生物合成途径形成的,其中关键酶查尔酮合成酶(chalcone synase, CHS)、查尔酮异构酶(chalcone isomerase, CHI)和黄酮3-羟化酶(flavanone 3-hydroxylase, F3H)将苯丙素前体p- coumaryl - CoA与3个丙二酰CoA分子浓缩转化为二氢山纳酚(图1A)。二氢山奈酚可通过类黄酮39羟化酶(F39H)进一步催化合成二氢槲皮素。二氢山奈酚和二氢槲皮素是二氢黄酮醇的两种主要成分,作为常见的前体,它们可以被黄酮醇合成酶(FLS)催化形成各种副色素黄酮醇和糖苷衍生物,也可以被二氢黄酮醇还原酶(DFR)催化形成花青素生物合成的第一步(图1A) (Harborne and Williams, 2000;Winkel-Shirley, 2002)。在拟南芥中,DFR只有一个单一的基因,而FLS则由一个由6个基因组成的小家族编码(Owens et al.,2008;Preuss等人,2009)。
黄酮类物质生物合成的转录控制已经被深入研究(Broun, 2005),遗传筛选已经确定了几种转录调控因子。第一组包括四种MYB蛋白,即生产花青素色素s1 (PAP1)、PAP2、MYB113和MYB114。过表达任何一种都会导致花青素积累的增加(Borevitz et al., 2000;Gonzalez等人,2008年)。第二组编码三个冗余的bHLH因子,即TT8、GL3和GLABRA3增强子(EGL3),同时失活导致花青素缺乏(Zhang et al., 2003)。MYB和bHLH蛋白与含有WD40重复序列的蛋白透明种皮GLABRA1 (TTG1)结合形成转录复合体,激活花青素生物合成基因,包括花青素合成酶(ANS)、DFR、F39H、白花青素双加氧酶、udp -葡糖基转移酶78D2 (UGT78D2)、和UDP-GLUCOSYL TRANSFERASE 75C1 (UGT75C1)(图1A) (Tohge等,2005;Gonzalez等人,2008年)。另外三个密切相关的MYB蛋白MYB11、MYB12和MYB111调控类黄酮途径的早期步骤,包括由CHS、CHI、F3H和FLS1编码的酶催化的步骤(Stracke et al., 2007)。此外,MYBL2,一种r3 - MYB相关蛋白,通过干扰MYB-bHLH-WD40复合物的形成来发挥抑制作用(Dubos等,2008;Matsui等人,2008)。最后,外侧器官边界域(LATERAL ORGAN BOUNDARY DOMAIN, LBD)基因家族的三个成员LBD37、LBD38和LBD39最近被确定为花青素生物合成的负调控因子(Rubin et al., 2009)。
然而,类黄酮生物合成基因对各种生物和非生物胁迫因子的响应已经被广泛研究(Lea et al., 2007;Lillo et al.,2008),对拟南芥黄酮醇和花青素积累的发育调控知之甚少。近年来,研究发现了一种microRNA (miRNA), miR156,作为植物发育的多效调节因子。miR156的水平随着年龄的增长而逐渐降低,它针对的是一组名为SQUAMOSA启动子结合蛋白样(SPL)的转录因子(Wu and Poethig, 2006;王等,2009)。SPLs反过来又影响拟南芥的一系列发育过程。例如,它们通过激活另一种miR172来促进营养相变,并通过MADS box基因和叶状叶诱导开花(Wang et al., 2009;Wu et al., 2009;Yamaguchi等,2009)。此外,SPLs在调节胚胎发育(Nodine和Bartel, 2010)、细胞大小(Wang et al., 2008;Usami et al., 2009),叶片产量(Wang et al., 2008),花器官上毛状体的形成(Yu et al., 2010),以及育性所需(Xing et al., 2011)。
在这里,我们发现拟南芥从叶子形成到花形成的转变与黄酮醇与花青素的比例变化密切相关。两者都被至少一个miR156靶向的SPL因子SPL9直接调控。我们认为,SPLs通过破坏MYB-bHLH-WD40转录复合物来协调花青素的生物合成与开花的过渡。
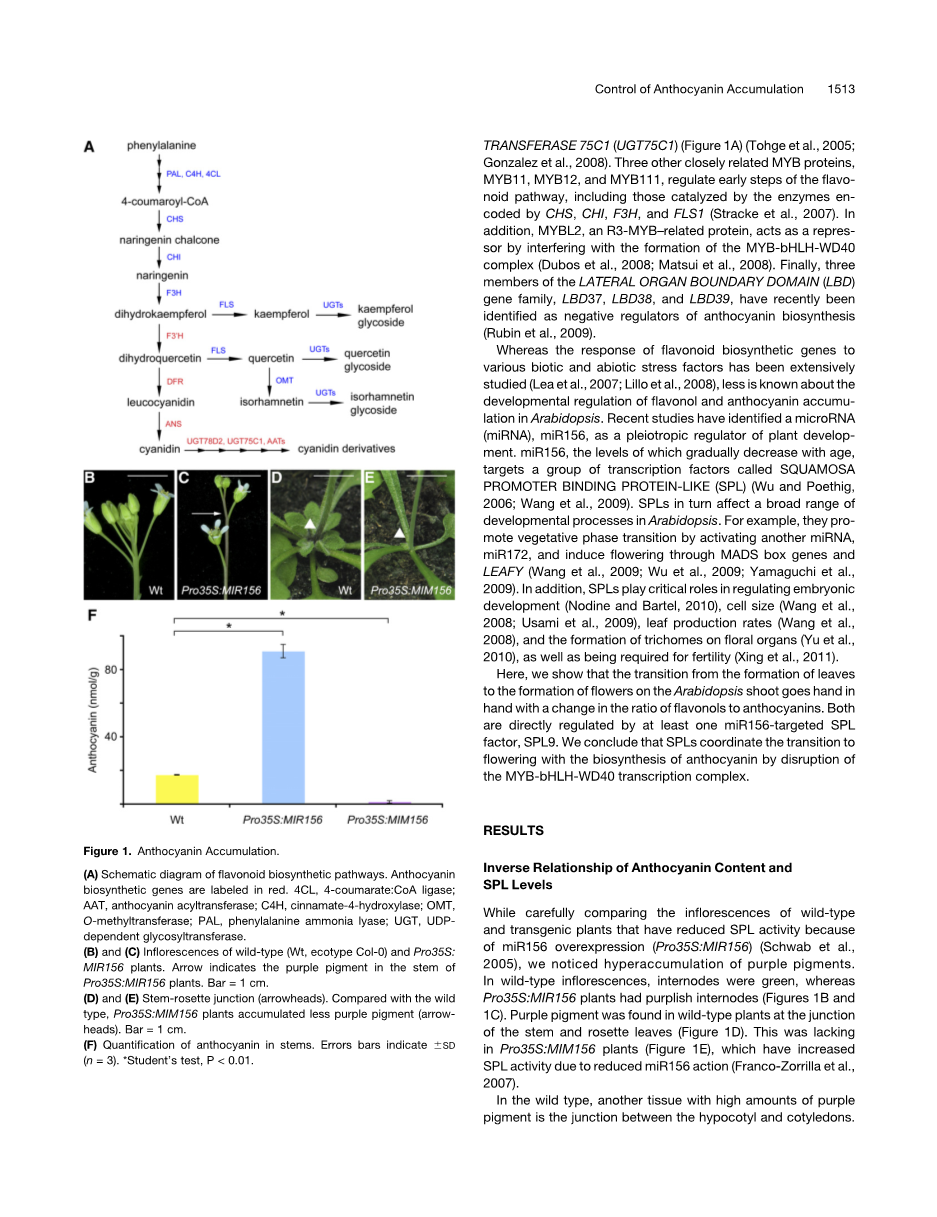
图1所示。花青素积累。(A)类黄酮生物合成途径示意图。花青素生物合成基因用红色标记。4 cl, 4-coumarate: CoA连接酶;AAT,花青素酰基转移酶;C4H cinnamate-4-hydroxylase;OMT O-methyltransferase;苯丙氨酸解氨酶;UGT, UDPdependent糖基转移酶。(B)和(C)野生型(Wt,生态型Col-0)和Pro35S: MIR156植株的花序。箭头为Pro35S:MIR156植株茎部的紫色色素。杆= 1厘米。(D)和(E)茎-莲座结(箭头)。与野生型相比,Pro35S:MIM156植株积累的紫色色素较少(箭头)。杆= 1厘米。(F)茎中花青素的定量。误差条表示6SD (n = 3)。*学生的测试,P lt; 0.01。
2.1 花青素含量与SPL水平成反比
在仔细比较因miR156过表达而降低了SPL活性的野生型和转基因植物(Pro35S: miR156)的花序时,我们注意到紫色色素的过度积累。在野生型花序中,节间为绿色,而Pro35S:MIR156植株的节间为紫色(图1B和1C)。在野生型植物的茎和莲座叶交界处发现了紫色色素(图1D)。这在Pro35S:MIM156植物中是缺乏的(图1E),这些植物由于miR156作用降低而增加了SPL的活性(Franco-Zorrilla等人,2007)。
在野生型中,另一个具有大量紫色色素的组织是下胚轴和子叶之间的连接处。虽然Pro35S:MIR156积累了与野生型相同数量的紫色色素,但Pro35S:MIM156幼苗的下胚轴-子叶连接完全是绿色的(见在线补充图1)。
我们从野生型和转基因植物的茎中提取色素,并在530 nm处测量吸收,这表明与野生型相比,Pro35S:MIR156茎中花青素含量约高4倍,而Pro35S:MIM156茎中花青素含量约低1 / 10(图1F),这与可见的颜色变化是一致的。
2.2. SPL9亚家族对花青素合成的调控
拟南芥基因组包含11个miR156靶向的SPL基因。这些SPL基因可分为两大类,分别以SPL3和SPL9为代表(Cardon et al., 1999)。为了了解哪一组SPL基因调控花青素的生物合成,我们研究了SPL失去功能的突变体。spl3-1突变体是在Wassilewskija (Ws)背景下发现的(Wu和Poethig, 2006)。SPL3-1在幼苗和花序中的紫色色素与野生Ws植物相同(见在线补充图2)。在SPL9亚家族中,SPL9和SPL15尤为重要(Schwarz et al.,2008;王等,2008)。然而,SPL9-4、 SPL15-1双突变体在下胚轴-子叶接合处或花序中花青素水平并没有增加(见在线补充图1和2),表明几个mir156靶向的SPLs对花青素生物合成有冗余调控。
然后我们研究了过表达单个SPL基因的植物。SPL9或SPL10都来自SPL9亚家族,但不属于SPL3,过表达SPL9或SPL10会减少茎和莲座丛之间的花青素积累(见在线补充图2)。综上所述,这些结果表明,SPL9型SPL基因的上调与Pro35S:MIM156植物的表型有关,而SPL3亚家族在调节花青素生物合成方面的作用微乎其微。
图2黄酮醇水平的LC-MS分析。(A)到(C)野生型(A)、Pro35S:MIR156 (B)和Pro35S:MIM156 (C)茎部可溶性酚类化合物的LC-MS谱图。插图显示了峰1和峰2的质谱和结构,分别对应于山奈酚3- o -鼠李糖苷7- o -鼠李糖苷(K-3-R-7-R;(见[A])和K-7-R(见[C])。茂,milliabsorbance单元。(D) Pro35S:MIR156和Pro35S:MIM156野生型植株茎部黄酮醇含量的定量分析。数据代表三次试验的平均值。误差条表示6 SD (n = 3)。*学生的测试,P lt; 0.01。Wt,野生型。
2.3. 黄酮类化合物在转基因植物中的积累
由于黄酮醇和花青素是由常见的前体合成的,我们还分析了SPL活性升高和降低的植物的黄酮醇含量。用甲醇从茎中提取可溶性酚类化合物,并进行液相色谱-质谱(LCMS)分析。考虑到之前在拟南芥中报道过的包括糖苷在内的类黄酮糖苷衍生物阵列(Yonekura-Sakakibara et al., 2008),我们用b-葡萄糖苷酶处理酚类提取物,以简化化合物的LCMS鉴定并促进其定量。经消化后,鉴定了两种山奈酚衍生物,山奈酚3- o -鼠李糖苷7- o -鼠李糖苷和山奈酚7- o -鼠李糖苷(K-7-R)和山奈酚3- o -a- l -鼠李糖苷7- o -a- l -鼠李糖苷(Veit和Pauli, 1999)。经b-葡萄糖苷酶消化后,前两个结合物可转化为K-7-R。在Pro35S:MIR156植物中,这两种山奈酚衍生物的含量都很低,不到野生型的十分之一(图2B和2D)。相比之下,Pro35S:MIM156植物中两种山奈酚衍生物的含量增加了1.6- 2.9倍(图2C和2D)。在我们的分析条件下,在野生型茎中未检测到另一种黄酮醇、槲皮素和/或其衍生物;此外,在Pro35S:MIR156和Pro35S:MIM156茎的酚类提取物的多阶段MS分析中,仅发现了可以忽略的分子和加合离子水平,质荷比为449和303,这表明槲皮素鼠李糖苷。综上所述,这些数据揭示了拟南芥茎中黄酮醇(主要是山奈酚衍生物)积累与花青素之间的拮抗关系。Pro35S:MIR156植株SPL水平降低时,花青素水平升高,黄酮醇水平下降。在Pro35S: MIM156中,SPL水平的增加会产生相反的效果。
在拟南芥茎提取物中,除黄酮醇外,还检测到几种分子量较高的酚类化合物(图2A)。虽然这些代谢物的性质仍有待最终确定,但Pro35S: MIR156植物中有四种代谢物的含量下降到野生型水平的四分之一左右(见补充图3)。与黄酮醇类似,这些酚类衍生物在Pro35
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 20 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[597906],资料为PDF文档或Word文档,PDF文档可免费转换为Word
课题毕业论文、文献综述、任务书、外文翻译、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 利用微生物诱导的碳酸盐沉淀法对Pb污染进行生物修复后的土壤物理结构研究外文翻译资料
- 使用单细胞滴基微流体形成的微生物诱导碳酸钙沉淀物的矿物学外文翻译资料
- 通过计算机信息实验研究和体外验证来鉴定新型上皮性卵巢癌的候选药物外文翻译资料
- 炎症相关癌症中的NOD样受体信号传导:从功能到靶向治疗外文翻译资料
- 细胞分裂周期相关基因作为肝细胞癌诊断和预后的生物标志物外文翻译资料
- 编码线粒体前序蛋白酶催化亚基PMPCB突变导致儿童早期神经病变外文翻译资料
- 多根螺旋藻 Nramp 转运蛋白基因在镉积累中的作用外文翻译资料
- 评估海藻提取物的抗根结线虫作用:一种元分析方法外文翻译资料
- 河口线虫生活史特征对表面活性剂十二烷基硫酸钠的响应外文翻译资料
- 质膜H -ATP酶发挥功能的分子基础及其在农业生产中的潜在应用外文翻译资料


