开花的通讯评审
拟南芥花器官详述
Frank Wellmer1,*, Emmanuelle Graciet1,2 和 Joseacute; Luis Riechmann3,4,*
1.墨菲特遗传学研究所,都柏林大学圣三一学院,都柏林,爱尔兰
2.爱尔兰国立梅努斯大学生物系,爱尔兰
3.农业基因组学研究中心(岩)csic-irta-uab-ub,巴塞罗那,西班牙
4.Institucioacute;Catalana de Recerca i EstudisAvanccedil;ats(ICREA),西班牙巴塞罗那
*通信方式 邮箱: wellmerf@tcd.ie 或者joseluis.riechmann@cragenomica.es
2013年8月31日收到;2013年10月17日修订;2013年10月18日接受
摘要
花器官是由一小部分转录调节因子的活性所决定的,是花器官的特征基因。广泛的遗传和分子分析表明,这些蛋白质是花发育的主调节因子。不仅在器官鉴定中起作用,而且在器官形态发生过程中也起作用。虽然它现已证实,这些转录因子在高水平的蛋白质复合物中起调控转录的作用,但是它们所控制的基因表达方案在很大程度上仍然是难以捉摸的。最近,为其功能的详细见解已经通过一系列实验相结合的方法获得的,包括转录组学和蛋白质组学方法。
在这里,我们回顾了在从主要模式植物拟南芥的花器官识别因子的表征方面取得的进展,我们讨论这些调节器下游的过程。我们进一步概述开放的问题,我们
相信需要解决,以获得一个更全面的观点,管理器官器官发育和规范的分子过程。
关键词:拟南芥,花器官特征的因素,花发育,同源异型突变
导言
拟南芥花组成的花器官的四种不同类型,即同心圆排列或轮生。从外面(第一轮)的中心(第四轮)他们是萼片、花瓣、雄蕊和心皮,(图 1A)。花器官是由一小部分调节基因组成,即所谓的花器官特征基因,这是基于其花具有同源器官转化突变体的鉴定,即更换(至少)的另一种类型的花器官(克里泽克和弗莱彻,2005;causier等 al.,2010;鲍曼等 al.,2012)。这些突变体的显著表型已被那些像Hox基因的同源异型突变,赋予动物身体前后轴的节段性,是非功能性的。(美国,2002;布罗夫斯克,2010)。然而,与Hox基因相比之下,它编码的同源结构域转录因子,大多数花器官同源基因编码MADS域家族转录因子(Lohmann和Weigel,
2002;杰克,2004;克里泽克和弗莱彻,2005),表明这些功能相似的主调控基因具有不同的进化起源。
从花卉同源异型突变体的遗传和表型分析可以得出,花器官特征基因以组合方式起作用以控制花器官形成所需的发育程序(Bowman等,1989,1991b,1993)。这个结果提供了可以说是植物中最知名的遗传模型的基础科学,花器官特征规范是ABC模型(Schwarz-Sommer等,1990; Bowman等,1991b,1993; Coen和Meyerowitz,1991)。根据这个模型,萼片在拟南芥中的形成是由豌豆控制的功能基因APETALA1(AP1)和APETALA2(AP2);
其他被子植物之间花发育控制方面的显着差异。在这篇综述中,我们将介绍一些导致这些结论并修改原始ABC模型的工作。我们还将讨论最近取得的进展,这些进展可以深入了解花器官特征因子下游的基因表达程序,并更好地了解花器官如何指定。 最后,我们将讨论需要解决的开放问题,以便更全面地了解花器官发育和分化的分子机制。
花器官规格的时机
花器官原基出现在花分生组织的特征性模式中,花分生组织自身来源于花序分生组织。 在拟南芥中,首先发生萼片原基,然后是花瓣和雄蕊的发生,最后,在发育中的花的中心开始心皮发育(Smyth等,1990)。一旦心皮原基已经形成,干细胞就存在于花分生组织中进行分化以防止花的过度生长。 分生组织确定性的这种控制是通过调控基因的复杂网络完成的,其中C功能基因AG起着关键作用(在Sun和Ito,2010中综述)。
花器官原基被认为是从花分生组织L1(最上面的)细胞层(Bossinger和Smyth,1996)的少量(2-8)花器官发生细胞发育而来。 类似于其他植物体的形成,花器官原始体的发生和生长依赖于不同植物激素的活性,并且特别是在原始分生组织的花分生组织区域形成生长素浓度最大值。事实上,参与生长素生物合成,运输和反应的基因中的突变体常常表现出严重的花缺陷,包括花器官损失(Cheng和Zhao,2007)。 生长素在建立花轮中不同类型花器官的基本不变布置方面也起着关键作用。 例如,已经显示花瓣的起始取决于转录因子PETAL LOSS(PTL),其活性似乎影响生长素可用性并因此影响花被中生长素最大值的形成(Lampugnani等,2013)。生长素是否也推动花器官创始细胞本身的规格目前还不清楚。 有人提出,在形成可检测的生长素最大值之前可以表达花器官形成细胞标记基因DORNROuml;SCHEN-LIKE(DRNL)(Chandler,2011; Chandler等,2011)。 因此,生长素可能不直接参与创始人细胞的规格。 然而,鉴于生长素合成,运输和反应之间复杂而动态的相互作用,以及它与其他激素的功能相互作用(Vanstraelen和Benkova,2012),生长素确实可能是花器官形成的诱导信号。
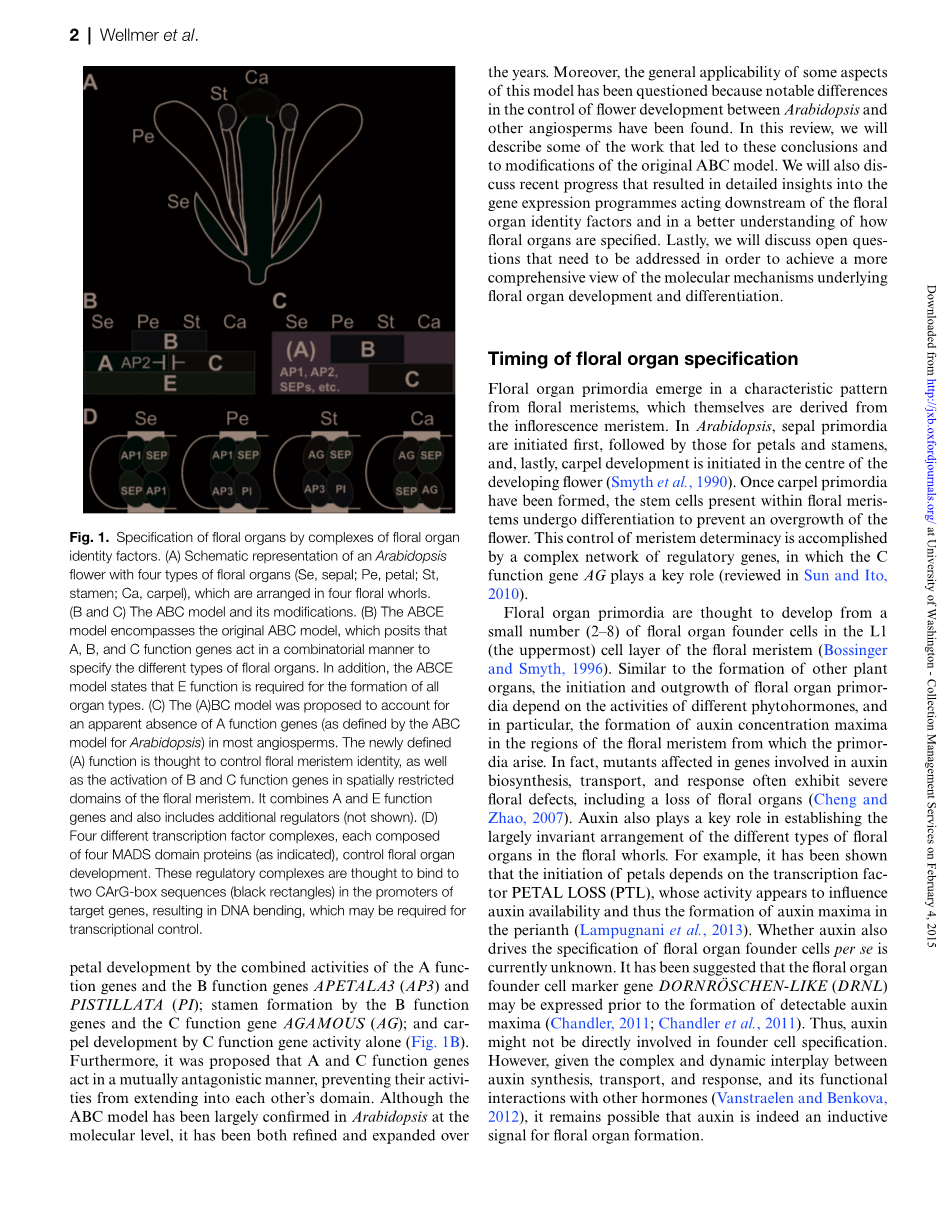
图1 .通过花器官特征因子的复合物来指定花器官。(A)具有四种花器官的拟南芥花(Se,萼片; Pe,花瓣; St,雄蕊; Ca,心皮)的示意图,其被布置在四个花轮中。(B和C)ABC模型及其修改。(B)ABCE模型包括原始ABC模型,其假设A,B和C功能基因以组合方式起作用以指明不同类型的花器官。此外,ABCE模型指出E功能是所有形成所必需的器官类型。 (C)提出(A)BC模型以解释在大多数被子植物中明显缺少A功能基因(由拟南芥ABC模型定义)。新定义的(A)功能也被认为控制花分生组织的身份,作为花分生组织中空间限制性区域中B和C功能基因的激活。它结合了A和E功能基因,并且还包括其他监管机构(未显示)。 (D)四个不同的转录因子复合物,每个复合物由四个MADS结构域蛋白组成(如所示),控制花器官发育。这些调节复合物被认为与靶基因启动子中的两个CArG盒序列(黑色矩形)结合,导致DNA弯曲,这可能是转录控制所需的。
通过A功能基因和B功能基因APETALA3(AP3)和PISTILLATA(PI)的组合活动使花瓣发育; 通过B功能基因和C功能基因AGAMOUS(AG)形成雄蕊; 和仅由C功能基因活性导致的心皮发育(图1B)。此外,有人提出,A和C功能基因以相互对抗的方式起作用,阻止它们的活动扩展到彼此的领域。虽然ABC模型在分子水平上在拟南芥中得到了很大程度的确认,但多年来它已被完善和扩大。此外,该模型的一些方面的普遍适用性受到质疑,因为已经发现在拟南芥和
一旦花器官原基开始启动,花器官特征基因的表达就会在它们通过高度复杂的调控基因网络指明的器官中被激活(OMaoileidigh等,2013a综述)。 B和C功能基因的定时激活和/或扰动实验显示,在这些基因开始表达后不久就指定了繁殖花器官
(Bowman等,1989; Ito等,2007; Wuest等,2012; OMaoileidigh等,2013b)。相反,尽管事实上A和B功能调节子已经在初期花瓣原基中表达,但花瓣的命运似乎是在花发育的更多中间阶段后期确定的(Wuest等,2012)。这一观察结果与早期花发育过程中花瓣原基生长缓慢(与其他器官类型相比)较慢(Smyth等,1990)。但是,这种延迟发展是迟到的原因还是后来规范事件是未知的。萼片规格的时间尚未确定,但有人认为萼片是花器官的默认状态(Causier等,2010)。因此,萼片的身份可能是通过所谓的花分生组织识别基因的活性来指定花分生组织的结果(在Wellmer和Riechmann,2010中综述)在花开始时发展。
花器官特征基因的表达不仅在花期早期被观察到,而且在其大部分发育过程中都持续存在于花器官中(Yanofsky等,1990; Bowman等,1991a; Jack等,1992; Mandel等1992; Goto和Meyerowitz,1994)。这种延长的表达表明它们不仅控制规格而且控制花器官的分化。事实上,通过激活和/或微扰实验,表明花器官特征因子调节器官形态发生过程中的不同过程,包括小孢子
发生,花药形成以及器官生长和成熟(图2)(Bowman等,1989; Ito等,2007; Wuest等,2012; OMaoileidigh等,2013b)。在花发育过程中花器官特征因子的不同功能的分子基础是什么?虽然这个问题的答案仍然大部分是未知的,但近年来在理解这些主要监管机构的活动方面取得了相当大的进展。这一过程中一个特别重要的步骤是确定ABC模型的分子机制。
ABC模型:修改和分子基础
如上所述,自20年前推出以来,ABC模型已被完善和扩展(Causier等,2010; Bowman等,2012)。一个主要的修订是通过鉴定四种SEPALLATA基因(SEP1-SEP4)而产生的,它们以部分冗余的方式起作用并且是A,B和C功能基因的活性所需要的(Pelaz等,2000; Ditta等2004)。与大多数其他花器官特征基因编码MADS结构域蛋白一样,SEP基因被纳入ABC模型中,赋予E功能(这个命名是由事实上D功能以前曾被用于指定胚珠同一性的基因),导致ABCE模型(图1B)。对拟南芥以外被子植物的研究表明花发育的遗传基础与模型植物相似,突出了开花植物的共同进化起源(Soltis等,2007)。同时,已经描述了花卉发育基因网络的几种(通常是细微的)修饰,正如可以预期的那样,基于在被子植物物种间发现的花卉结构的显着差异。
图2.花器官识别基因在花发育过程中的活性。 指出花器官特征基因是不同类型花器官的规格,生长和分化所需的近似发育阶段。 萼片规格发生的花期不明确(用颜色梯度表示)。 此外,尚不清楚花器官特征基因是否促进萼片生长(用问号表示)。
Sagerstrom,2013)。事实上,已经鉴定了几种MADS结构域蛋白复合物的辅因子候选物(C.Liu等,2009; Simonini等,2012; Smaczniak等,2012),并且它们的表征有助于更详细地了解MADS结构域的分子基础花器官身份规范。
控制花器官发育的基因表达程序:全球视野
在21世纪初期基因组时代出现之前,主要通过使用经典的遗传学和分子生物学方法(Savidge等,1995; Ito等, 1997年; Sablowski和Meyerowitz,1998年)。随着技术的进步,通过使用DNA微阵列和下一代DNA测序的转录组学方法(Wellmer and Riechmann,2005),可以更加系统地鉴定花器官识别因子下游的基因。最初的一行研究基于花同源突变体的花与相应的野生型花的基因表达谱的比较(Zik和Irish,2003; Wellmer等,2004; Alves-Ferreira等,2007; Peiffer等2008)。这些实验导致鉴定数百个基因,其表达取决于花器官特征因子的活性。这些转录本中的许多在四种花器官中的一种中显示特异性或主要表达。与花生器官的无菌器官(即萼片和花瓣)相比,与繁殖花器官的形态复杂性增加相一致,绝大多数这些转录物被分配到雄蕊和心皮,这意味着高度专业化的基因表达程序是这些器官类型形成的基础。这些研究中的一个警告是,它们通常是用整个花序进行的,主要是鉴定在花发育的晚期阶段(当花芽相对于早期花原基相对较大时)表达的基因,并且因此在花器官 身份已被指定。 此外,在大多数情况下,尚不清楚鉴定的基因是否由花器官特征因子直接调控,或者它们在器官分化过程中是否进一步下游。
为了鉴定在花发育早期受花器官特征因子控制的基因,采用了几种不同的实验方法。在花卉诱导系统的帮助下,该系统可以从单个植物中收集数百个同步的早期花芽(Wellmer等,2006),并将核糖体亲和纯化(TRAP)与下一代测序相结合( TRAPSeq)中鉴定出数百个在AP1,AP3和AG表达域中富集的转录物(焦和Meyerowitz,2010)。另一种确定早期应答基因的方法依赖于幼花花器官特征因子的特异性激活或扰动,再次导致鉴定大量候选基因(Gomez-Mena等,2005; Wuest等, ,2012; OMaoileidigh等,2013b)。为了确定花器官特征因子的直接目标,将来自不同转录组实验的结果与全基因组定位研究的结果进行比较,所述研究现已针对所有A,B和C功能调节器进行
然而,拟南芥和其他被子植物的发现之间的主要区别是许多开花植物中真正缺乏真正的A功能基因(Litt and Kramer,2010)。 这一发现导致了对A函数概念的重新评估,并提出了一个修改后的花器官特征规范模型,该模型似乎比原始ABC模型更普遍适用(Causier等,2010)。 这个称为(A)BC(图1C)的新模型基于A和E功能基因[在修订后的模型中统称为(A)功能]主要涉及指定花分生组织 ,而不是花器官,并通过确保B和C功能调节子的正确表达域来介导花卉图案。 根据这个模型,萼片是花器官的默认状态(见上文)。因此,萼片在ap1和ap2突变花中不存在的事实可能是不能正确指定花分生组织的间接结果。 这个模型得到了几项研究的结果的支持,这些研究表明AP1和AP2确实在花分生组织的规范中发挥
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 9 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[281324],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 利用微生物诱导的碳酸盐沉淀法对Pb污染进行生物修复后的土壤物理结构研究外文翻译资料
- 使用单细胞滴基微流体形成的微生物诱导碳酸钙沉淀物的矿物学外文翻译资料
- 通过计算机信息实验研究和体外验证来鉴定新型上皮性卵巢癌的候选药物外文翻译资料
- 炎症相关癌症中的NOD样受体信号传导:从功能到靶向治疗外文翻译资料
- 细胞分裂周期相关基因作为肝细胞癌诊断和预后的生物标志物外文翻译资料
- 编码线粒体前序蛋白酶催化亚基PMPCB突变导致儿童早期神经病变外文翻译资料
- 多根螺旋藻 Nramp 转运蛋白基因在镉积累中的作用外文翻译资料
- 评估海藻提取物的抗根结线虫作用:一种元分析方法外文翻译资料
- 河口线虫生活史特征对表面活性剂十二烷基硫酸钠的响应外文翻译资料
- 质膜H -ATP酶发挥功能的分子基础及其在农业生产中的潜在应用外文翻译资料


