大麦籽粒总淀粉、直链淀粉和支链淀粉的全基因组关联分析揭示新的等位基因
作者:Mengdi Li , La Geng , Shanggeng Xie , Dezhi Wu , Lingzhen Ye and Guoping Zhang
单位:Institute of Crop Science, Zhejiang University, Hangzhou 310058, China
摘要:谷物中淀粉的含量和组成与产量密切相关。对大麦中与这些性状相关的基因或位点的鉴定研究很少。本研究旨在鉴定大麦籽粒中控制淀粉性状的基因或位点,包括总淀粉(TS)、直链淀粉(AC)和支链淀粉(AP)含量。所有供试淀粉性状均存在较大的基因型变异。GWAS分析分别检测到13、2、10个TS、AC和AP 的QTL,其中5个QTL是AP和TS含量共有的,qTS-3.1、qAC-6.2和qAP-5.1可能分别解释TS、AC和AP的最大变异。4个候选基因,即HORVU6Hr1G087920、HORVU5Hr1G011230、HORVU5Hr1G011270和HORVU5Hr1G011280,在发育中的大麦籽粒淀粉快速积累时表现出高表达。根据标记S5H _ 29297679的多态性,将供试的100份大麦材料分为两个类群,其中93份具有GG等位基因,7份具有AA等位基因。而且,所鉴定QTL的有利等位基因数与TS、AC、AP含量呈显著正相关。综上所述,本研究鉴定的位点或基因可用于大麦籽粒淀粉的遗传改良。
关键词:大麦;总淀粉(TS);直链淀粉(AC);支链淀粉(AP);核心种质;全基因组关联研究(GWAS);基因型差异;数量性状位点(quantitative trait locus,QTL)。
1. 引言
大麦(Hordeum vulgare L.)的种植面积仅次于玉米、水稻和小麦(FAOSTAT 2018),是全球第四大谷类作物。与其他谷物一样,大麦谷物中的主要成分是碳水化合物,主要是淀粉,约占总干重的62-77%[1,2]。大麦籽粒中的淀粉由直链淀粉和支链淀粉组成,其数量和比例对大麦作为食品时的营养和口感品质以及酿造工业中用作原料时的麦芽品质有很大影响[3-5]。根据直链淀粉含量,大麦可分为蜡质型(直链淀粉5%以下)、高直链淀粉型(直链淀粉gt;35%)和普通型(直链淀粉5-35%)[6]。一般来说,大部分大麦品种都属于普通型。对254个春大麦品种的研究表明,直链淀粉和支链淀粉含量变化范围分别为16.74 % ~ 30.92 %和26.47 % ~ 42.97 % [6]。另一项研究利用来自不同地区的39个大麦品种,发现4个蜡质品种直链淀粉含量为2.5 - 8.3 % [7]。总体而言,对大麦籽粒直链淀粉和支链淀粉含量的遗传变异研究较少。
直链淀粉的合成受编码颗粒结合淀粉合成酶Ⅰ(GBSSI)的Waxy基因控制,而支链淀粉的合成受几种相关酶的调控,包括可溶性淀粉合成酶(SSS)、淀粉分支酶(SBE)、淀粉脱分支酶(DBE)、葡聚糖水二激酶(GWD) [8]。这3种关键酶在支链淀粉的支化、去支化和磷酸化中起着必不可少的作用,保证了适当分子结构的形成。有文献报道,Wx基因的精确编辑导致了直链淀粉含量和籽粒特性的改变[9]。Sex6突变体缺乏淀粉合成酶Ⅱa(ssⅡa)活性导致支链淀粉含量降低,链长分布缩短,糊化温度降低[10]。淀粉分支酶I(sbe1)突变体表现出明显的支链淀粉结构改变[11]。含糖突变体淀粉脱支酶I(dbe I)缺陷,影响支链淀粉的生物合成。过量表达马铃薯GWD提高了大麦颖壳淀粉中淀粉结合磷酸盐的含量[12]。虽然上述合成酶基因与淀粉性质有关,但淀粉的含量和比例也受到许多调控因子的控制[13]。例如,APETALA2 /乙烯响应元件水稻淀粉调节因子1(RSR1)调节直链淀粉含量和支链淀粉结构[14]。迄今为止,此类调节剂在大麦中的研究很少。总之,淀粉的生物合成过程非常复杂且调控精细。因此,为了阐明大麦淀粉的生物合成过程,有必要对这些调控因子进行鉴定。
全基因组关联研究(GWAS)是一种基于表型和基因型关联的鉴定控制复杂性状的基因或位点的有效方法[15、16]。GWAS分析已经对大麦的许多复杂性状进行了分析,包括耐盐性[17]、耐旱性[18]、抗斑点叉(SB) [19]、制麦品质[20]和农艺性状[21]。在本研究中,我们利用基于GWAS的鉴定大麦淀粉相关基因或位点的方法,利用100份来自国际大麦核心种质。由此,鉴定了几个控制大麦籽粒总淀粉、直链淀粉和支链淀粉含量的显著QTL。
2. 结果与分析
2.1. 淀粉性状的表型变异
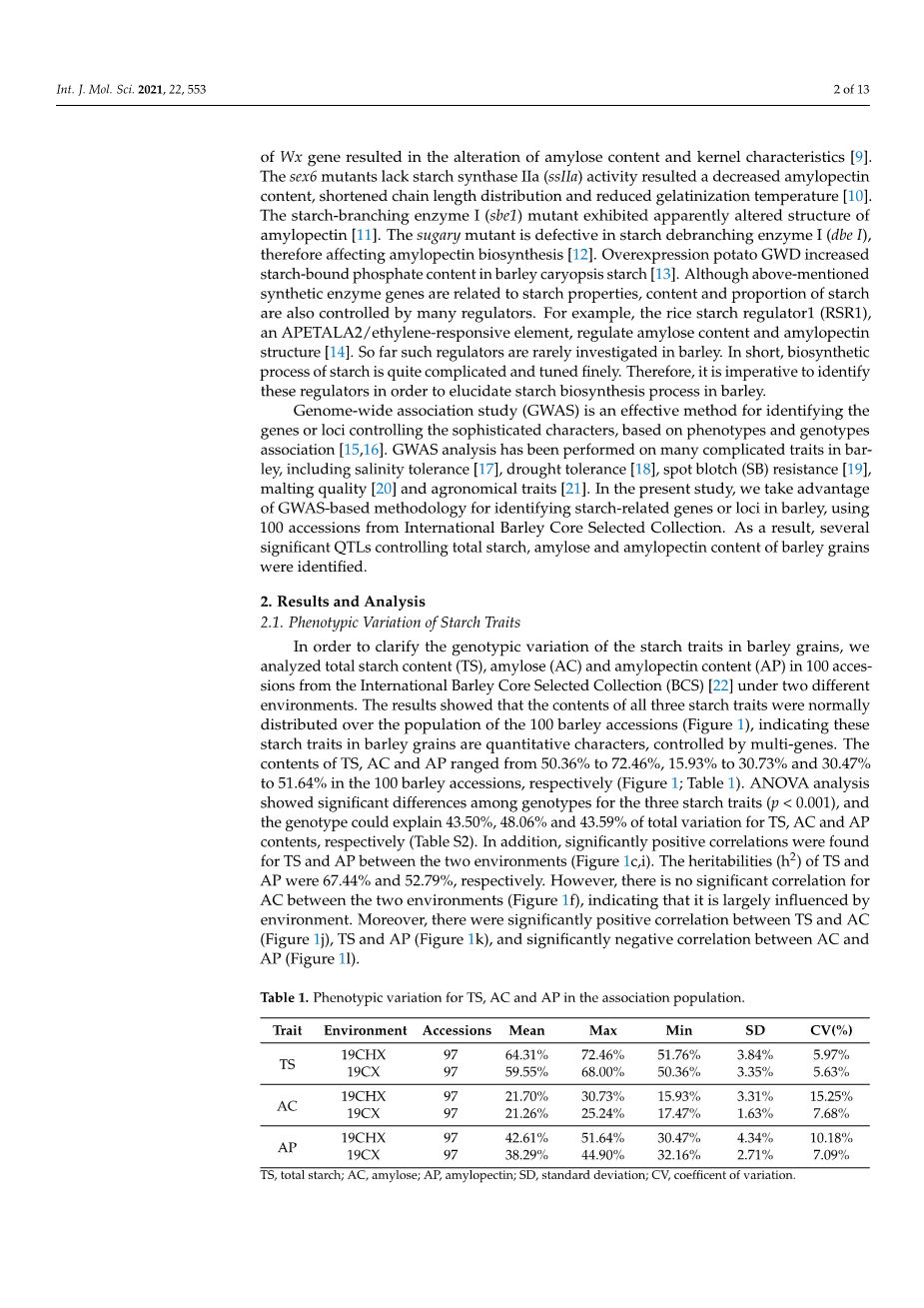
为了明确大麦籽粒淀粉性状的基因型变异,我们对来自国际大麦核心种质(BCS) [22]的100份大麦材料在两种不同环境下的总淀粉含量(TS)、直链淀粉(AC)和支链淀粉含量(AP)进行了分析。结果表明,这3个淀粉性状的含量在100份大麦种质群体中都正态分布(图1),说明这些淀粉性状在大麦籽粒中是数量性状,受多基因控制。100份大麦(图1,表1)中TS、AC和AP含量分别为50.36 % ~ 72.46 %、15.93 % ~ 30.73 %和30.47 % ~ 51.64 %。方差分析表明,3个淀粉性状的基因型间差异极显著(p lt; 0.001),基因型分别解释了TS、AC和AP含量总变异的43.50 %、48.06 %和43.59 %(表S2)。此外,TS和AP在两种环境间均呈显著正相关(图 1c , i)。TS和AP的遗传力(h2)分别为67.44 %和52.79 %。然而,两种环境之间的AC没有明显的相关性(图1f),说明其受环境的影响很大。此外,TS与AC呈显著正相关(图1j),TS与AP呈显著负相关(图1k),AC与AP呈显著负相关(图1l)。
表1 .关联群体中TS、AC和AP的表型变异
图1. TS、AC、AP含量的频率分布及相关性分析。(a , b)长兴、慈溪两地TS的频率分布;(c)长兴与慈溪TS的相关性;(d , e)长兴、慈溪两地交流频率分布;(f)长兴与慈溪的AC相关性;(g , h)长兴、慈溪两地AP的频率分布;(i)长兴与慈溪AP的相关性;(j) TS与AC的相关性;(k)TS与AC的相关性;(l) AC与AP的相关性。TS:总淀粉含量。AC:直链淀粉含量。AP:支链淀粉含量。* *分别在p lt; 0.01水平上显著(两尾)。
2.2. 全基因组关联分析
为了探索与淀粉含量相关的遗传因素,利用100份BCS材料的淀粉含量数据和SNP位点进行了全基因组关联分析。因此,在1,084,274个SNP标记中,获得191,147个小等位基因频率(MAF) gt; 5 %,缺失率lt; 15 %的筛选标准,用于进一步GWAS分析。平均标记密度为0.0396 SNP / 千碱基(表S3)。
基于全基因组关联定位,在E1(长兴)、E2(慈溪)和E3(E1和E2的平均值)中分别检测到了p lt; 10-4、19、18和16个TS QTL;AC分别有8、14、6个QTL,AP分别有18、15、19个QTL(表S4)。这些QTL分布在大麦基因组全部7条染色体上(图2、图S2和S4)(表S4)。利用QQ图可以说明观测到的p值与预期的p值之间的关系,这说明当直线接近对角线但有尖锐的向上偏离尾部时,假阳性和假阴性都得到了很好的控制[23]。我们的结果显示,预测的p值与实际值比较接近,表明结果可靠,且关联SNPs的假阳性和假阴性率较低(图S2)。
图2 .支链淀粉含量的曼哈顿图(a) E1(长兴)曼哈顿图。(b) E2(慈溪)的曼哈顿图。(c)平均数据的曼哈顿图。折线表示显著性阈值(p lt; 10 - 4)。
在两个以上环境中鉴定的QTL被认为是稳定的。在已鉴定的QTL中,TS、AC和AP含量分别检测到13、2和10个稳定QTL(表S4)。在这些稳定的QTL中,解释TS表型变异最大的位点为qTS-3.1,位于3H染色体上,占E3总变异的27.15 %,在E1和E2中也检测到。AC的主效QTL为qAC-6.2,约占表型变异的20 %。AP的主效QTL为qAP-5.1,与标记S5H _ 29297679相关联,解释E3总变异的25.7 %,在E1和E2也可检测到。此外,该QTL还在E3中检测到TS(表S4)。
在上述稳定QTL中,TS和AP均检测到5个QTL。例如,与qAP - 2.1相同的qTS - 2.1位点,与标记S2H _ 484808981关联,在TS和AP中均被鉴定,解释表型变异的21.46 % ~ 26.01 %。同样,qTS-3.1(qAP-3.1 , S3H _ 176458677)、qTS-6.2(qAP-6.2 , S6H _ 349173230)、qTS-6.3(qAP-6.3 , S6H _ 469691793)和qTS-7.1(qAP-7.1 , S7H _ 26188860)均与TS和/或AP显著相关,分别占表型变异的20.92 % ~ 27.15 %、15.57 % ~ 21.18 %、17.52 % ~ 25.98 %和16.68 % ~ 21.25 %(图S5,表2)。
表2. 在GWAS分析中鉴定出TS、AC和AP的稳定QTL
2.3. 与重要Qtls相关的候选基因的鉴定
在3个主效QTL和5个普通QTL中,一个主效QTL与一个普通QTL qTS - 3.1(qAP-3.1)一致。基于7个对TS、AC和/或AP高度显著的QTL,在显著关联标记上下游100 kb范围内搜索候选基因。因此,在这7个QTL的plusmn;100 kb范围内共检测到25个基因。从大麦基因组数据库中获得25个候选基因的转录表达信息。在删除全生育期不表达的候选基因后,利用15个候选基因绘制表达热图,表明这些候选基因的转录水平在不同组织和发育阶段(图 3 ;表 S5)差异较大。值得注意的是,与qAC-6.2和qAP-5.1相关的基因HORVU6Hr1G087920、HORVU5Hr1G011230、HORVU5Hr1G011270和HORVU5Hr1G011280在授粉后第5 ~ 15天(DAP),即淀粉在籽粒中快速积累时,在发育中的籽粒中呈现高表达(图3)。因此,这四个可能的候选基因与籽粒淀粉积累高度相关。
图3 . 15个候选基因在不同组织和发育阶段表达水平的热图。EMB:4天胚,ROO1:幼苗的根(10cm梢期),LEA:幼苗的芽(10cm梢期);INF1:幼嫩发育的花序(5mm);INF2:发育花序(1 - 1.5cm);NOD:发育分蘖,第3节间(42 DAP);CAR5:发育中的籽粒(5 DAP);CAR15:发育中的籽粒(15 DAP);ETI:黄化苗,暗色圆锥形。(10 DAP);LEM:花序,外稃(42 DAP);LOD:花序,小叶(42 DAP);PAL:散生花序,内稃(42 DAP);EPI:表皮条(28 DAP);RAC:花序,花序轴(35 DAP);Roo2:根(28dap)。SEN:衰老叶片(56 DAP)。
单倍型分析表明,4个候选基因中的2个基因HORVU5Hr1G011270和HORVU5Hr1G011280在AP含量上存在极显著差异(p lt; 0.01)(图 4a , b ;表 S6和 S7)。基因HORVU5Hr1G011270包含11个SNPs多态性,涉及100个BSC集合中的5种单倍型(表S6)。Hap4的平均AP含量为36 %,显著低于其他4个基因型。另一方面,基因HORVU5Hr1G011280存在5个SNPs多态性,导致4个前列型(表S7)。Hap4的平均AP含量为38 %,显著低于其他3个基因型。此外,这两个基因也是与大麦籽粒AP含量相关的同一QTL(qAP-5.1 ,标记 S5H _ 29297679)的候选基因。在100份大麦种质中,根据标记S5H _ 29297679的多态性可分为2个类群;93份材料具有GG等位基因,7份材料具有AA等位基因。该标记的多态性与表型数据吻合较好(图4c)。AA型平均AP含量为32.95 %,显著低于GG型(40.79 %)(p lt; 0.001)。此外,该QTL还与TS相关。因此,可能提示该QTL及相关候选基因在大麦籽粒AP含量测定中具有重要意义。
图4 .基于表型变异最大解释的AP积累的单倍型和表型差异。(a)根据11个SNPs的多态性,HORVU5Hr1G011270产生5种单倍型。(b)根据5个SNPs的多态性,HORVU5Hr1G011280产生4种单倍型。(c)根据QTL qAP - 5.1(S5H _ 29297679)将100份大麦种质分为AA和GG两组基因型的平均数据。不同字母表示显著差异(p lt; 0.05)。 剩余内容已隐藏,支付完成后下载完整资料

英语原文共 13 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[597895],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 在线粒体中,肌动蛋白调节线粒体DNA转录,是线粒体质量控制所必需的外文翻译资料
- 水稻转运蛋白——自然抗性相关巨噬细胞蛋白(NRAMP)家族的生物信息学分析外文翻译资料
- 大麦籽粒总淀粉、直链淀粉和支链淀粉的全基因组关联分析揭示新的等位基因外文翻译资料
- 人工合成群落中食细菌线虫与捕食性细菌的行为交互作用外文翻译资料
- RNA靶向的CRISPR系统 ——从宏基因组到RNA调控外文翻译资料
- 通过农杆菌真空浸润和共培养渗透(发芽)种子使烟草脆裂病毒介导小麦和玉米的全株水平病毒诱导的基因沉默外文翻译资料
- 一种来自盐生植物Atriplex Canescens(Pursh)Nutt.的重金属分离蛋白质(AcHMA1),在酿酒酵母中表达对铁和其他非生物胁迫的耐受性外文翻译资料
- 初中生信息素养概况外文翻译资料
- 概念转变:对科学教育的理论,方法和实践挑战的探讨外文翻译资料
- 互联网学习满意度的性别差异外文翻译资料


