抗炎剂。1。2-氨基-3-苯甲酰基苯乙酸的合成及抗炎活性研究
William J. Welstead, Jr.,* H. Wayne Moran, Harold F. Stauffer, Lennox B. Turnbull, and Lawrence F. Sancilio
A. H. Robins Company, Richmond, Virginia 23220. Received October 23, 1978
摘要:介绍了2-氨基-3-苯甲酰基苯乙酸的合成及其抗炎活性。该化合物被假设为7-苯甲酰基吲哚啉的活性代谢物,以解释后者的意外抗炎活性。对14C标记的7-苯甲酰基吲哚啉的代谢研究没有证实这一假设。然而,2-氨基-3-苯甲酰基苯乙酸及其乙酯和钠盐在药理模型中显示出强有力的抗炎活性。
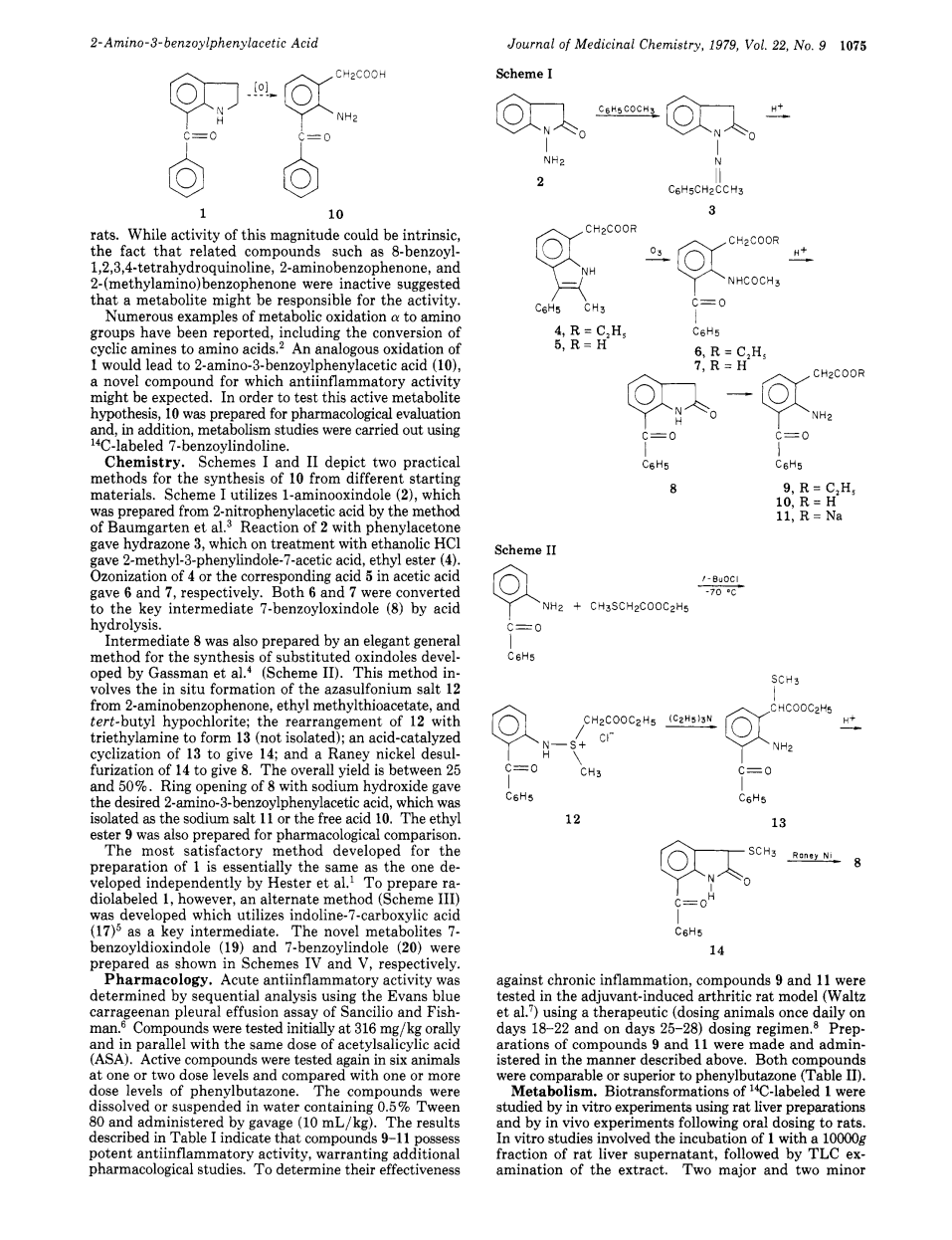
在一系列三环苯二氮杂卓类化合物的合成过程中,合成了若干双环氨基苯二酚类化合物作为中间体。在大鼠的伊文思蓝卡拉胶胸腔积液模型中,我发现一种化合物,7-苯甲酰基吲哚啉(1)[1] 具有意想不到的抗炎活性,可与苯基丁氮酮相媲美。虽然这种强度的活性可能是固有的,但相关化合物,如8-苯甲酰基- 1,2,3,4-四氢喹啉、2-氨基苯甲酮和2-甲氨基-二苯甲酮是不活跃的,这表明具有活性的可能是代谢产物。
有很多alpha;位代谢氧化为氨基的例子,包括环胺转化为氨基酸。[2] 化合物1的类似氧化可生成2-氨基-3-苯甲酰基苯乙酸(10),这是一种可能具有抗炎活性的新化合物。为了验证这一活性代谢物假说,制备了化合物10进行药理学评价,并使用14C标记的7-苯基吲哚啉进行代谢研究。
化学研究。方案I和方案II描述了从不同起始材料合成化合物10的两种实用方法。方案I 使用1-氨基羟吲哚(2),其利用Baumgarten 等人[3] 的方法由2-硝基苯乙酸制得。化合物2和苯丙酮反应生成腙3,经乙醇HC1处理生成2-甲基-3-苯基吲哚-7-乙酸以及2-甲基-3-苯基吲哚-7-乙酸乙酯(4)。化合物4或相应的酸5在乙酸中臭氧化分别得到6和7。通过酸水解,6和7均转化为关键中间体7-苯甲酰基辛醇(8)。
中间体8也是由Gassman等人[4] 的取代羟吲哚类化合物的合成方法制备的(方案II)。该方法包括2-氨基苯甲酮、甲基硫代乙酸乙酯和叔丁基次氯酸盐原位形成氮杂锍盐12;12与三乙胺重排形成13(未分离);酸催化13环化得到14,雷尼镍脱硫14得到8。总收率在25%到50%之间。用氢氧化钠开环8得到所需的2-氨基-3-苯甲酰基苯乙酸,分离为钠盐11或游离酸10。还制备了乙酯9以进行药理学比较。
为制备1而开发的最令人满意的方法基本上与Hester等人[1]独立开发的方法相同。然而,为了制备放射性标记的1,开发了一种替代方法(方案III),其利用吲哚啉-7-羧酸(17)[5]作为关键中间体。新代谢物7-苯甲酰二氧吲哚(19)和7-苯甲酰基吲哚(20)的制备分别如方案IV和V所示。
药理学研究。采用Sancilio和Fishman[6] 的伊文思蓝卡拉胶胸腔积液测定法,通过序贯分析确定急性抗炎活性。最初以316 mg/kg口服并与相同剂量的乙酰水杨酸(ASA)平行试验。在六只动物身上以一个或两个剂量水平再次测试活性化合物,并与一个或多个剂量水平的苯基丁氮酮进行比较。将化合物溶解或悬浮在含有0.5%吐温80的水中,灌胃给药(10ml/kg)。表I中描述的结果表明化合物9-11具有有效的抗炎活性,值得进一步药理学研究。为了确定其对慢性炎症的有效性,化合物9和11在佐剂诱导的关节炎大鼠模型(Waltz等人[7]),使用治疗性(在第18-22天和第25-28天每天一次)给药方案进行试验。以上述方式制备并管理化合物9和11。这两种化合物的抗炎活性与苯基丁氮酮相当或优于苯基丁氮酮(表II)。
新陈代谢。通过大鼠肝脏制剂的体外实验和大鼠口服给药后的体内实验进行研究14C标记的化合物1的生物转化。体外研究涉及将化合物1与10000g大鼠肝脏清液的部分培养,随后进行薄层色谱分离提取物的胺化。检测到两种主要和两种次要生物转化产物,以及未改变的1(表III)。在最大浓度(25%)下发现的代谢物在检查条件下不稳定,但通过加入抗坏血酸钠作为抗氧化剂到系统中,然后在薄层色谱分离后用乙酸酐/吡啶处理代谢物。红外光谱、紫外光谱和质谱鉴定该化合物为19的乙酸衍生物。同样的衍生物也是从19的真实样品中合成的。另一种主要代谢物通过红外、紫外和质谱综合鉴定为化合物20。这两种次要代谢物未经鉴定,但TLC显示与10或其环衍生物8不同。
在体内研究中,尿液和粪便中的药物相关成分未被鉴定。然而,TLC显示尿液中不存在化合物10、8或1,粪便中只含有1。
讨论。为了解释化合物1意想不到的抗炎活性,提出了活性代谢物假说。然而,实验上,在代谢提取物中,没有检测到代谢物10,也没得到更稳定的环状衍生物8。此外,发现化合物19和20(1的主要净代谢物)几乎没有抗炎活性(表I)。尽管如此,化合物10及其两个衍生物9和11显示出对急性炎症的有效抗炎活性,而9和11在抑制慢性炎症方面显示出与标准品苯基丁氮酮相当或更高的活性。
其他药理学研究表明,化合物11与苯基丁氮酮相比,具有较强的镇痛活性(在抑制狗对缓激肽的伤害性反应方面是苯基丁氮酮的36.3倍)并且与苯基丁氮酮相比,其抑制佐剂诱导的关节炎大鼠的未注射足的足水肿的效力与其产生肠损伤的效力具有更高的治疗比率。[8] 化合物11目前正在进行临床研究。[9]
实验部分。熔点是在托马斯·胡佛熔点仪的开放毛细管中测定的,未经校正。核磁共振谱是在瓦里安A-60光谱仪上获得的,红外光谱在贝克曼IR8上获得,质谱在日立珀金-埃尔默RMU-6H质谱仪上获得。使用Perkin Elmer 240型元素分析仪获得碳、氢和氮的元素分析,并且在理论的plusmn;0.4%范围内。所有化合物的光谱数据与提议的结构一致。
1-(alpha;-甲基苯亚乙基亚氨基)羟吲哚(3)。将10.0g (0.07mol) 1-氨基羟吲哚和9.05g (0.07mol) 苯丙酮在65mL无水乙醇中的搅拌混合物加热至所有羟吲哚溶解,用0.5mL羟基乙酸处理,并在蒸汽浴上再加热15分钟。冷却反应混合物后,过滤沉淀的固体,并用H2O稀释滤液以获得额外固体。固体从无水乙醇中重结晶,得到16.0克 (90%)的纯净化合物3,mp 102-104 ℃。分析,(C17H16N2O) C, H, N。
2-甲基-3-苯基吲哚-7-乙酸乙酯(4)。将10.0g (0.04mol) 化合物3在150mL无水乙醇中的搅拌悬浮液在N2气氛下加热至回流温度,然后用过量的干燥氯化氢气体处理40min。在冰水中冷却后,过滤混合物以去除不溶性1-氨基羟吲哚,并浓缩滤液以得到油。将油溶解在轻石油得到6.5g(58%)的化合物4,mp 108-109℃,结晶。分析,(C19H19NO2) C, H, N.
2-甲基-3-苯基吲哚-7-乙酸(5)。将6.0g (0.02mol) 化合物4在80mL含有8.0g氢氧化钾的水溶液中的搅拌悬浮液加热回流2小时。冷却至室温后,过滤反应混合物,并用等体积的H2O处理滤液。用3 N盐酸酸化滤液,得到沉淀,将其过滤并从C6H6中重结晶,得到3.7g (67%) 的化合物5,mp 165℃ dec.分析,(C17H15NO2) C, H, N.
(2-乙酰胺基-3-苯甲酰苯基)乙酸(7)。用臭氧(威尔斯巴赫臭氧发生器)处理2.0g (0.007mol)化合物5,在60mL HoAc中的搅拌溶液15分钟。KI溶液用于指示反应何时完成。反应混合物用10毫升H2O稀释并浓缩。残余物从i-PrOH中重结晶,得到1.6g (71%) 化合物7,mp 188-190℃。分析,(C17H15NO4) C, H, N.
(2-乙酰胺基-3-苯甲酰苯基)乙酸乙酯(6)。将5.0 g (0.017mol ) 化合物4在75毫升HOAc中的搅拌溶液臭氧化,如实施化合物5所述。臭氧化完成后,用H2O稀释溶液并用Et2O萃取。用H2O和5% NaHCO3水溶液洗涤Et2O提取物,干燥(MgSO4),并在减压下浓缩,得到固体残留物。固体从i-PrOH中重结晶得到2.6g (47%)化合物 6,mp 133-134℃。分析,(C19H19NO4) C, H, N.
7-苯甲酰基辛醇(8)。方案A:根据化合物6或7。将2.5g (0.008mol) 化合物6溶于50mL 3N氯化氢的搅拌混合物加热回流1小时并过滤,将滤液倒入冰上。将所得沉淀物从乙酸乙酯-甲苯中重结晶,得到1.0 g (55%)的化合物8,mp 154℃。 分析,(C15H11NO2) C, H, N. 使用相同的程序,化合物7以相当的产率得到8。
方案B:根据化合物14。102g (0.36mol)化合物14在1.2L THF中于15℃在N2气氛下的搅拌溶液,用6.15g商业制备的雷尼镍分批处理2小时。添加完成后,将混合物搅拌1.5小时,然后过滤。用700 mL THF清洗滤饼,用5 N HCI逐滴处理组合滤液,直到深红色变为绿黄色(pH-6)。减压下溶液的浓度为80.0 g(94%)粗品化合物8,可如上所述进行纯化。
7-苯甲酰基-3-(甲硫基)羟吲哚(14)。将300g (1.52mol) 2-氨基苯甲酮在4升二氯甲烷中的搅拌溶液冷却至-40℃,并用204g (1.52mol) 2-(甲硫基)乙酸乙酯在5升二氯甲烷中的溶液处理。将混合物冷却至-65℃,用164克(1.52摩尔)叔丁基次氯酸盐在500mL二氯甲烷中的溶液滴加处理。添加完成后,将混合物在-70℃下搅拌2小时,用182 g (1.8 mol) 的Et3N处理几分钟,并使其升温至室温。用H2O洗涤反应混合物,干燥(MgSO4),减压浓缩,得到油状残余物。油溶于1.5升甲醇,用1升1 N HCl处理,回流加热2小时。冷却溶液后,沉淀343 g(80%)粗品14(含5-10%氨基苯甲酮)。通过从甲苯中重结晶固体制备分析样品,mp 130℃。分析,(C16H13NO2S) C, H, N.
4,5-二氢吡咯[3,2,l-hil]呋喃-l,2-二酮(16)。向100g(0.79mol)草酰氯与300mL干乙醚的搅拌溶液中,逐滴添加200g(1.7mol)吲哚啉。周末搅拌混合物,然后浓缩,得到半固体残渣。用乙醚研磨残渣,使所需的酸性氯化物溶解,不溶性双酰胺保持不溶解。减压下乙醚提取物的浓度为90.0g(58%)粗酸氯化物(15)。向3L烧杯中的化合物15加入285 g(2.1 mol)的AlCl3。将反应物充分混合并在热板上快速加热至100-110℃。在110℃下继续搅拌,直到HCl停止释放(15分钟)。将混合物冷却,倒入冰上,并用CHCl3萃取。将CHCl3提取物干燥(MgSO4)并在减压下浓缩,得到油状残留物。用丙酮研磨油得到红色固体,该固体由苯重结晶得到23.0克(基于起始吲哚啉的8.3%)化合物16,mp 206-208℃。分析, (C10H7NO2) C, H, N.
吲哚-7-羧酸(17)。将22.0g (0.13mol)化合物16和40.0g (1mol)氢氧化钠在400mL H2O中的混合物在室温下搅拌30分钟,并用40mL 30% 过氧化氢在400mL H2O中处理。添加完成后,将混合物搅拌3 h,然后用C6H6清洗。将水层的pH值调整为6.6,然后用CHCl3提取该层。将CHCl3提取物干燥(MgSO4)并在减压下浓缩,得到油作为残渣。用C6H6/异辛烷(75:25)研磨残渣得到15.0g(73%)接近
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 6 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[597590],资料为PDF文档或Word文档,PDF文档可免费转换为Word
课题毕业论文、文献综述、任务书、外文翻译、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 抗炎剂。1。2-氨基-3-苯甲酰基苯乙酸的合成及抗炎活性研究外文翻译资料
- 丙酮催化加氢制异丙醇:一种环境友好的方法外文翻译资料
- 夹竹桃科植物夹竹桃的内生真菌代谢产生的长春胺吲哚生物碱的鉴定外文翻译资料
- 先兆子痫生理病理学最新研究进展外文翻译资料
- 氟醚麻醉剂的合成与反应外文翻译资料
- 醋酸纤维素电纺纳米纤维:现状和生物技术的应用范围外文翻译资料
- 生物催化还原活化的C=C键及其他键:新兴趋势外文翻译资料
- Ag/Ti02复合气凝胶增强吸附光催化降解气相中甲苯的合成与表征.外文翻译资料
- 代谢工程改造解脂耶氏酵母利用木糖的研究外文翻译资料
- 新分离的肠杆菌HY1降解对苯二甲酸二乙酯及其酯酶性质的研究.外文翻译资料


